有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。R是由A、D两元素形成的离子化合物,其中A+与D2一离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体内晶体类型应属于 (填写“六方”、“面心立方”或“体心立方”)堆积,空间利用率为 。
(2)C3-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化,CB3分子的VSEPR模型为 。
(3)C的氢化物在水中的溶解度如何 ,为什么具有这样的溶解性 。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:
(用元素符号表示);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是p g·cm-3试计算R晶体中A+和D2-最短的距离 。
(阿伏加德罗常数用NA表示,只写出计算式,不用计算)
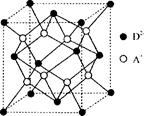
23. (1)体心立方 68% (2)1s2 2s2 2p6 sp3 四面体形
(3)l:700溶于水或极易溶于水
氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水。
(4)C1>P>S ;H2S+Cl2="2HCl+S"

题目分析:B原子得一个电子填入3p轨道后,3p轨道已充满,故B为氯,A+比B-少一个电子层,故A为钠,C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,氮元素形成的氢化物氨气形成分子间氢键,使溶解度增大,故为N,;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数,故D为硫;(1)钠是体心立方密堆积,空间利用率为 68% ;(2)N3-有8个电子,最外层为全充满,故为1s2 2s2 2p6;NCl3形成三条单键和一对孤对电子,故为sp3杂化,是四面体形;(3)氨气极易溶于水,氨气分子间能形成分子间氢键,且和水均为极性分子,故在水中的溶解度很大;(4)同周期,从左向右整体第一电离能逐渐增大,与硫相邻的为磷和氯,但磷为半充满,稳定,第一电离能大,故C1>P>S;单质间的置换反应可以证明单质氧化性的强弱,故为:H2S+Cl2=2HCl+S;(5)该晶体中钠离子个数为8,硫离子有处于面上的和顶点上的,个数为4,晶胞的体积等于质量除以密度,质量为4个硫化钠的质量,由体积求出立方体的边长,四个硫和一个钠构成正四面体,钠位于正四面体的体心,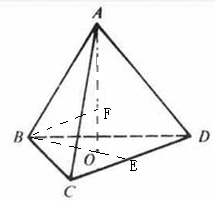 四面体的棱长为晶胞面对角线的一半,由边长求出棱长,根据棱长求出正三角形中BE的长,根据BO和OE的比值为2:1得出BO的长,根据AB和BO求出AO的长,根据三角形中的数量关系求出最短距离。
四面体的棱长为晶胞面对角线的一半,由边长求出棱长,根据棱长求出正三角形中BE的长,根据BO和OE的比值为2:1得出BO的长,根据AB和BO求出AO的长,根据三角形中的数量关系求出最短距离。
