叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为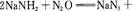
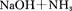
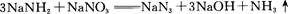 回答下列问题:
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是 ,第一电离能最小的元素是 。
(2)基态氮原子的L层电子排布图为 。
(3)与N3-互为等电子体的分子为 (写出一种)。依据价层电子对互斥理论,NO3-的空间构型为 。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为 。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因: 。
(5)N20沸点(一88.49℃比NH3沸点(一33.34℃)低,其主要原因是
(6)安全气囊的设计原理为
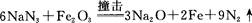
①氮分子中δ键和π键数目之比为 。
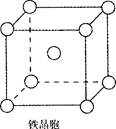
②铁晶体中存在的化学键类型为 。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为
(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。
22. (1)氟(或F) 锂(或Li)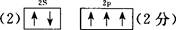
(3)CO2或N2O 平面三角形
(4)离子晶体(1分)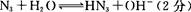
(5)氨分子间存在氢键 (6)1:2 金属键 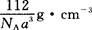
题目分析:(1)氮元素在第二周期,同周期,从左向右电负性依次增大(稀有气体除外),故为氟;第一电离能逐渐增大,故最小的为锂;(2)氮原子L层上有5个电子,先排s上的2个电子,再排p上的三个电子;(3)N3-价电子总数为16,等电子体的为价电子总数相等的CO2或N2O;先算出孤电子对数为(5+1-2×3)/2=0,成键电子对为3,故为sp2杂化,故为平面三角形;(4)两者均含有钠离子和阴离子,故为离子晶体,盐溶液显碱性为阴离子水解,故为N3-结合水电离出的氢离子生成氨气和氢氧根离子;(5)氨气分子能形成分子间氢键,沸点升高;(6)①氮气中形成氮氮三键,有一条δ键和2条π键,故为1:2;②铁为金属晶体,存在金属键;③晶胞的体积为a3,有8个铁原子位于顶点,一个位于中心,故晶胞完全占有的铁原子数目为2个,质量为 ×2g,质量除以体积得密度。
×2g,质量除以体积得密度。
