(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。

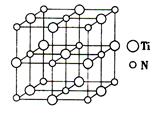
图3 图4
(6)部分化学键的键能见下表:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。
(1)Be、C、O (2) +3 ;Cl—、H2O (3)B;三角锥型 (4)2 (5) Ti4CN3
(6)>;<; 360×4+436×2—(176×2+431×4)=+236
题目分析:(1)同周期自左向右电离能逐渐增大,但由于Be元素的2s轨道电子处于全充满状态,稳定性强,因此Be元素的第一电离能大于B元素的第一电离能。氮元素的2p轨道电子处于半充满状态,稳定性强,因此氧元素第一电离能小于氮元素的第一电离能,因此第一电离能介于B、N之间的第二周期元素有Be、C、O。
(2)水分子整体是0价的,氯元素是-1价,则配离子[TiCl(H2O)5]2+的中心离子化合价为+3价,能够提供孤对电子的是配体,因此该配链子中配体的化学式为Cl—、H2O。
(3)①根据晶体Q的结构可知,分子中存在氢键、共价键、范德华力,另外B与O之间还有配位键,不存在阴阳离子,因此没有离子键,答案选B。
②R中阳离子是水合氢离子,其中氧原子的价层电子对数是4个,但含有1个孤对电子,因此其空间构型为三角锥形。
(4)根据球棍模型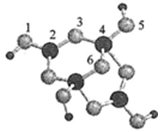 可知1,3,5,6代表氧原子,2,4代表B原子,观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2。
可知1,3,5,6代表氧原子,2,4代表B原子,观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2。
(5)根据晶胞结构可知晶胞中碳原子的个数=8×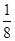 =1,氮原子个数=6×
=1,氮原子个数=6×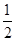 =3,Ti原子个数=12×
=3,Ti原子个数=12×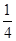 +1=4,所以晶胞的化学式为Ti4CN3。
+1=4,所以晶胞的化学式为Ti4CN3。
(6)①碳化硅和硅单质形成的晶体类型是原子晶体,由于碳原子半径小于硅原子,因此碳化硅的沸点高于单质硅的沸点。四氯化碳形成的晶体是分子晶体,二氧化硅形成的晶体是原子晶体,因此四氯化硅的沸点低于二氧化硅的沸点。
②化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和),晶体硅中1个硅原子形成2个共价键,所以根据方程式可知△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol。
