(12分):【化学——物质结构与性质】
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是 ,电负性最大的是 , 原子半径由小到大的顺序为 。 (填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
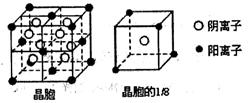
(3)A和E可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为 ,含阴离子的数目为 ,该离子化合物的化学式为 。
(1)Na (1分) F (1分)
F < Cl < Al < Na (2分)
(2)HF (1分) ,因为HF分子间存在氢键 ;(2分)
(3)4 (2分) 8 (2分) CaF2(1分)
题目分析:B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,D的原子半径是同周期原子中最小的,可知D为Cl元素,A、D同主族,则A为F元素,E和其它元素既不在同周期也不在同主族且原子序数最大,应为第四周期元素,前20号元素中只有Ca符合。
(1)根据A、B、C、D四种元素在周期表中的位置,第一电离能最小的是Na,电负性最大的是F,根据原子半径变化规律:同主族元素电子层数越多半径越大,同周期元素从左到右原子半径逐渐减小,则F < Cl < Al < Na。
(2)HF中的F元素原子半径小,元素的电负性较强,HF分子间能形成氢键,HCl分子间不含氢键,所以HF的沸点大于HCl。
(3)Ca2+位于晶胞的8个顶点和6个面的面心,所以每个晶胞含Ca2+:8×1/8+6×1/2=4;8个F‾全部位于晶胞内部,所以每个晶胞含F‾8个;因此该离子化合物的化学式为CaF2。
