某研究性小组在实验室中模拟炼铁化学原理的实验.
Ⅰ.定性探究
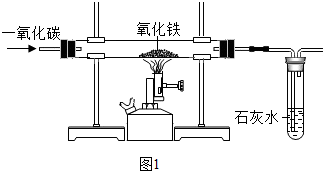
在一定温度下,该小组同学用一氧化碳还原纯净的氧化铁(实验装置如图1所示,从环保角度看,该小组设计的实验装置有不足之处,你认为该如何改进?______),观察到玻璃管内固体由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家分头查阅资料.
【查阅资料】
(1)一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
(2)一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
(3)
| 性质物质 | 四氧化三铁 | 氧化亚铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 能 |
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体全部能被吸引,则该黑色固体中不可能含有______.
(2)进行猜想:黑色固体可能
a.全部为铁b.______c.______
Ⅱ.定量探究
取上述研磨后的黑色固体20g,设计如下实验(如图2所示):
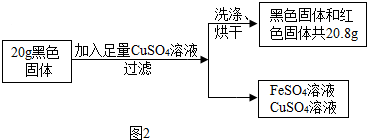
(1)小明同学的猜想是否成立?
(2)通过计算,确定20g黑色固体的成分及质量(请写出计算过程).
【继续试验】
若要从以上探究所得FeSO4、CuSO4的混合溶液中回收铜和硫酸亚铁晶体,可设计如下实验方案(如图3所示):
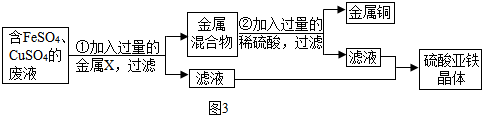
(1)步骤①中,金属X是______,该反应的化学方程式为______.
(2)步骤②中,加入过量稀硫酸的目的是______.
Ⅰ定性探究:尾气中的一氧化碳有毒会污染空气,应该将尾气点燃处理;
【实验与猜想】(1)由题意可知,黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化亚铁;(2)由题意可知,黑色固体粉末全部能被吸引,黑色固体粉末可能是全部为铁或全部为四氧化三铁或四氧化三铁与铁粉的混合物.
Ⅱ定量研究:(1)20g黑色固体粉末与足量的硫酸铜溶液充分反应后,得到硫酸亚铁溶液和铜,说明黑色粉末中含有铁,过滤得到的黑色固体是四氧化三铁,则金属混合物是铁和四氧化三铁的混合物;小明的猜想不成立;
(2)反应前后,固体质量增加了20.8g-20g=0.8g,设黑色固体中铁的质量为x
Fe+CuSO4═Cu+FeSO4 固体质量增加
5664 64-56=8
x 0.8g
=56 8 x 0.8g
x=5.6g
四氧化三铁的质量:20g-5.6g═14.4g
【继续试验】可以用过量的铁粉与硫酸铜反应生成铜和硫酸亚铁,因此X是铁;铁粉与硫酸铜反应生成铜和硫酸亚铁;然后再加入过量的稀硫酸把铜粉和铁粉混合物中的铁粉除去,为了将混合物中的铁粉除尽,所以加入的稀硫酸必须是过量的.
故答案为:Ⅰ.定性探究:点燃尾气;
【实验与猜想】(1)氧化亚铁;(2)全部为四氧化三铁;铁与四氧化三铁的混合物;
Ⅱ.定量研究:(1)不成立
(2)反应前后,固体质量增加了20.8g-20g=0.8g,设黑色固体中铁的质量为x
Fe+CuSO4═Cu+FeSO4 固体质量增加
5664 64-56=8
x 0.8g
=56 8 x 0.8g
x=5.6g
四氧化三铁的质量:20g-5.6g═14.4g
答:20g黑色粉末中含有5.6g铁粉和14.4g四氧化三铁.
【继续试验】(1)Fe;Fe+CuSO4═FeSO4+Cu;(2)除去过量的铁.
