问题
填空题
(6分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是 。
(2)R2+的水合离子中,提供孤电子对的原子是 。
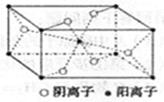
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数比是 。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是 。
答案
(1)1s22s22p4 ;(2)O; (3)2:1 (4)2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
题目分析:根据题意可推知:X是N;Y是O;Z是Mg;R的Cu。(1)O基态原子的电子排布式是1s22s22p4 ; (2)Cu2+的水合离子中,提供孤电子对的原子是H2O分子中的O原子;(3)根据晶胞结构示意图可知:阳离子:1+8÷1/8=2;阴离子:4×1/2+2=4.所以晶胞中阴离子与阳离子的个数比是4:2 = 2:1。(40根据题意,结合电子守恒、原子守恒可得相应反应的离子方程式:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。
