利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 。
(2)NH3中氮原子的杂化方式为 ;NH4+空间构型为 (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ,与C22-互为等电子体的分子有 (写化学式,举一例)。
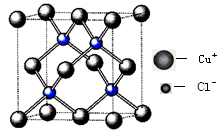
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 。
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 (写化学式)。
(1)1s22s22p63s23p63d10或[Ar]3d10(2分) (2)sp3(1分);正四面体(1分)
(3)3∶2(2分) ;N2或CO(2分) (4)4(2分) (5)NH3和CO(2分)。
题目分析:⑴根据基态铜原子的电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1,写出基态时亚铜离子核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;
⑵NH3中氮原子形成3个σ键同时有一个孤电子对,其杂化方式为sp3;NH4+中心原子氮原子形成了4个σ键,故其空间构型为正四面体;
⑶根据乙炔的结构式H-C≡C-H,可得乙炔分子中σ键与π键数目之比为3∶2;C22-属于双原子,10个价电子的微粒,与其互为等电子体的分子有N2或CO;
⑷根据氯化亚铜晶胞结构可计算晶胞中含Cu+数目为:8×1/8+6×1/2=4(个);
⑸配离子[Cu(NH3)3(CO)]+的中心原子为Cu,其配体有NH3和CO。
