问题
选择题
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-
C具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径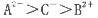
B.它们的原子半径C>B>A
C.它们的原于序数A>B>C
D.原子最外层上的电子数C>A>B
答案
答案:B
题目分析:由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素,B2+和C-具有相同的电子层结构,则B在C的下一周期,B处于第三周期第ⅡA族,故B为Mg元素,C为F元素,A、B同周期,则A为S元素;A、离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以A2->C->B2+,故A正确;B、A为S元素,B为Mg元素,C为F元素,同周期原子半径从左到右逐渐减小,电子层数越多,半径越大,则有B>A>C,故B错误;C、A为S元素,B为Mg元素,C为F元素,原子序数A>B>C,故C正确;C、;D、A为S元素,B为Mg元素,C为F元素,最外层电子数分别为6、2、7,故原子最外层上的电子数C>A>B,故D正确。故选B。
