(15分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
(1)第2周期ⅣA族; 三角锥形;
(2)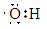

(3)Al(OH)3 + OH-==AlO2- + 2H2O
(4)NH3;sp3;H2O中O原子有2对孤对电子,H3O+中O原子有1对孤对电子,排斥力小
(5)S2-+ H2O HS- + OH- ;
HS- + OH- ;
2Na2O2(s) + 2H2O(1)="=4NaOH(aq)" + O2(g) △H=-20Q kJ/mol
题目分析:根据题意知,A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。B的最外层电子数是其电子层数的2倍,则B为碳元素;D是地壳中含量最多的元素,则D为氧元素,C为氮元素;A分别与C、D可形成含有10个电子的共价化合物M、N,则A为氢元素,M为NH3,N为H2O;D与G分别同主族,则G为硫元素,H为氯元素;A与E同主族,则E为钠元素;F位于B的前一主族,则F为铝元素。(1)元素B为碳元素,在周期表中的位置第2周期ⅣA族;M为NH3,空间构型是三角锥形;(2)A、D、E三种元素组成一种常见化合物氢氧化钠,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W为羟基,电子式见答案;工业上电解饱和氯化钠溶液生成氢氧化钠、氢气和氯气,化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。(3)氢氧化钠和氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3 + OH-==AlO2- + 2H2O;(4)NH3和H2O均能结合H+,其中结合H+能力较强的是NH3;H3O+中心原子采用sp3杂化,其键角比H2O中的键角大,原因为H2O中O原子有2对孤对电子,H3O+中O原子有1对孤对电子,排斥力小;(5)硫化钠的水溶液显碱性的原因是S2-+ H2O
2NaOH+H2↑+Cl2↑。(3)氢氧化钠和氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3 + OH-==AlO2- + 2H2O;(4)NH3和H2O均能结合H+,其中结合H+能力较强的是NH3;H3O+中心原子采用sp3杂化,其键角比H2O中的键角大,原因为H2O中O原子有2对孤对电子,H3O+中O原子有1对孤对电子,排斥力小;(5)硫化钠的水溶液显碱性的原因是S2-+ H2O HS- + OH- ;常温下7.8 g X与水反应放出Q kJ热量(Q>0),该反应的热化学方程式为2Na2O2(s) + 2H2O(1)="=4NaOH(aq)" + O2(g) △H=-20Q kJ/mol。
HS- + OH- ;常温下7.8 g X与水反应放出Q kJ热量(Q>0),该反应的热化学方程式为2Na2O2(s) + 2H2O(1)="=4NaOH(aq)" + O2(g) △H=-20Q kJ/mol。
