问题
填空题
(4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| a | |||||||
| b | c | d | |||||
(1)元素b的基态原子电子排布式为 。
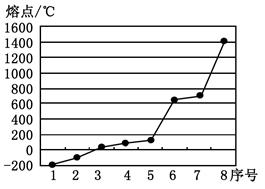
(2)第三周期8种元素按单质熔点高低的排列顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)元素a、c分别与元素d形成的化合物中,熔点较高的是(填化学式)。
答案
(1)1s22s22p63s2(1分)(2)Si(1分)2(1分)(3)SiCl4(1分)
题目分析:(1)根据元素在周期表中的位置可知,b是镁元素,基态原子电子排布式为1s22s22p63s2。
(2)根据图像可知8表示的电子熔点最高,应该是原子晶体硅。同周期自左向右非金属性逐渐增强,电负性逐渐增大,所以电负性最大的是氯元素。在8种单质中氯气的熔点仅比Ar高,所以应该是2。
(3)元素a、c分别与元素d形成的化合物是四氯化碳和四氯化硅,二者均是分子晶体,其中熔点较高的是四氯化硅。
