(15分)X、Y、Z、W为前四周期的元素,其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍。X与Y形成的常见化合物多于两种。Z与Y、W分处不同周期,且Z的离子是构成叶绿素中重要大环有机物的中心离子。W被称为继铁、铝之后的第三金属。请根据上述信息回答下列问题:
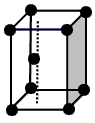
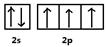
(1)请画出X基态原子价电子的电子排布图: 。
(2)X、Y、Z三种元素第一电离能由大到小顺序是: (写元素符号)。
(3)X最高价氧化物对应水化物中X的杂化方式是: 。
(4)X气态氢化物分子的空间构型为: ,X的气态氢化物与Y的气态氢化 物比较沸点高的是: (写分子式),键角较大的是 (写分子式)。
(5)W晶体的晶胞如图所示,其配位数为: 。假设该晶胞中的钛原子的直径为a pm, Na为阿伏伽德罗常数,请列式表示该晶体的密度为 g/cm3。
⑴  (2’)
(2’)
⑵N>O>Mg(2’)
⑶sp2(1’)
⑷三角锥形,H2O,NH3(各2’)
⑸12(2’),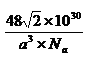 (2’)
(2’)
题目分析:X、Y、Z、W为前四周期的元素,其原子序数依次增大,Y元素最外层电子数是其内层电子数的3倍,则Y为O元素,X与Y形成的常见化合物多于两种,则X为N元素,Z的离子是构成叶绿素中重要大环有机物的中心离子,Z为Mg元素,W被称为继铁、铝之后的第三金属,则W为Ti元素。
(1)x为N元素,基态原子价电子为2s22p3,所以电子排布图为:
(2)N元素基态原子2p轨道排布了3个电子,半充满,为稳定状态,则N元素的第一电离能大于O元素的第一电离能,所以X、Y、Z三种元素第一电离能由大到小顺序是:N>O>Mg
(3)X最高价氧化物对应水化物为HNO3,N原子形成了3个σ键,不含孤对电子,所以N原子的杂化方式为sp2杂化。
(4)X气态氢化物为NH3,NH3分子的空间构型为三角锥形;NH3在常温下为气体,Y的气态氢化物为H2O,沸点为100℃,所以H2O的沸点更高;NH3中N原子和H2O中O原子都是sp3杂化,N原子有一对孤对电子,O原子有二对孤对电子,对成键电子对的排斥作用更强,所以NH3的键角较大。
(5)钛晶体为六方最密堆积,所以配位数为12;根据晶胞示意图和均摊法可知一个晶胞含Ti原子:8×1/8+1=2,则一个晶胞的质量为2×48/Na g,根据数学知识可求出一个晶胞的体积为 a3×10-30cm3,所以该晶体的密度2×48/Na÷
a3×10-30cm3,所以该晶体的密度2×48/Na÷ a3×10-30 g/cm3=
a3×10-30 g/cm3=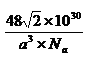 g/cm3
g/cm3