(9分)下表是元素周期表的一部分:
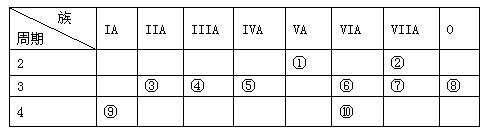
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 。
(2)化学性质最不活泼的元素是 ,其原子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是 。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是 。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是 。
(1)K(1分) F(1分) (2)Ar(1分) 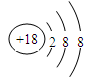 (1分)
(1分)
(3)Al(OH)3+OH-=[Al(OH)4]-(2分) (4)K>Si>Cl>F (2分) (5)H2SO4(1分)
题目分析:根据元素在周期表中的相对位置可知①~⑩号元素分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Se。则
(1)同周期自左向右金属性逐渐减弱,非金属性逐渐增强,同主族自上而下金属性逐渐增强,非金属性逐渐减弱,则在这些元素中,最易失电子的元素是K,非金属性最强的元素是F。
(2)化学性质最不活泼的元素是稀有气体元素Ar,其原子结构示意图为 。
。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物是氢氧化铝,与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是K>Si>Cl>F。
(5),同主族自上而下非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱,则元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是H2SO4。
