问题
问答题
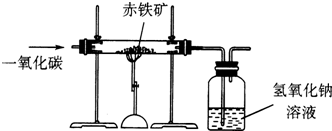
小明在学完铁的冶炼原理后,借鉴CO还原CuO的实验,设计了如图所示的装置,测定20g某赤铁矿石中氧化铁(Fe2O3)的质量分数.假设赤铁矿石中氧化铁全部还原为铁且CO2被氢氧化钠溶液完全吸收(有关反应方程式:3CO+Fe2O3
2Fe+3CO2).现记录数据如下表: 高温 .
| 实验前 | 实验后 | |
| 洗气瓶(包括氢氧化钠溶液) | 156.8g | 170.0g |
(1)20g赤铁矿石中氧化铁(Fe2O3)的质量分数?
(2)指出上述实验设计中的不合理之处,并说明理由.
答案
(1)洗气瓶内增加的重量就是生成二氧化碳的质量,所以生成的二氧化碳有:m(CO2)=13.2 g
设20g赤铁矿石中氧化铁的质量为x.
3CO+Fe2O3
2Fe+3CO2 高温 .
160 132
x 13.2g
=160 132 x 13.2g
x=16 g
Fe2O3的质量分数为:
×100%=80%16 20
答:20g赤铁矿石中氧化铁的质量分数为80%.
(2)因为尾气中的一氧化碳有毒,直接排放会造成空气污染,所以实验设计中的不合理之处是尾气未处理,直接排放到空气中.
答:尾气未处理,直接排放到空气中.
