问题
填空题
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | |||||||
| b | c | d | |||||
| e | f | g | |||||
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_____________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
答案
(每小题2分,共8分)
(1) 3 IIIA (2分) (2)NaOH+Al(OH)3=NaAlO2+2H2O (2分)
(3) 离子键、共价键 (2分) (4) 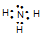 (1分) H2O(1分)
(1分) H2O(1分)
题目分析:(3)根据f在元素周期表中的位置可得在第三周期、IIIA;(2)e为钠,最高价氧化物对应的水化物为NaOH,f为铝,最高价氧化物对应的水化物为Al(OH)3,故方程式为:NaOH+Al(OH)3=NaAlO2+2H2O;(3)钠在空气中燃烧生成过氧化钠,钠离子和过氧根离子之间形成离子键,过氧根离子中两个氧原子之间形成共价键;(4)氨气的电子式注意氮原子的孤对电子;同周期从左向右气态氢化物的稳定性逐渐增强,故H2O>NH3。
