(10分)五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
(1)O<N< Al <Mg< Na;(2)离子键、共价键;(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)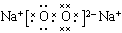 (5)Al-3e-+4OH-=AlO2-+2H2O。
(5)Al-3e-+4OH-=AlO2-+2H2O。
题目分析:根据题意可知这五种元素分别是:A是N;B是O;C是Na;D是Mg;E是Al。同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。所以这五种元素的原子半径由小到大的顺序是:O<N< Al <Mg< Na ;(2)O、Na形成的原子个数比为1:1的化合物物质乙Na2O2中存在的化学键类型是离子键、共价键;(3)由于Mg、Al都是金属,Al能够与碱反应,而Mg不能发生反应,所以可以用NaOH溶液除去D中少量的E,发生反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。(4)化合物Na2O2的电子式是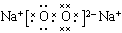 ;(5)若将D、E的单质插入NaOH溶液中,可以构成原电池,由于Al能够与NaOH发生反应,所以Al作负极,其负极反应是Al-3e-+4OH-=AlO2-+2H2O。
;(5)若将D、E的单质插入NaOH溶液中,可以构成原电池,由于Al能够与NaOH发生反应,所以Al作负极,其负极反应是Al-3e-+4OH-=AlO2-+2H2O。
