某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示,请回答下列问题.
(1)A处通入气体的化学式为______,仪器C的名称是______,C中盛有的试剂是______;
(2)B处发生反应的化学方程式是______;该套装置的不足之处是______;
(3)向20g赤铁矿粉通入足量气体,充分反应后,获得11.2g铁,则赤铁矿石中三氧化二铁的质量分数为______.
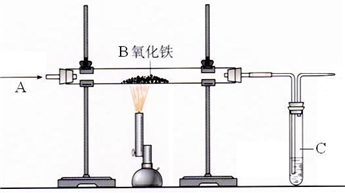
(1)炼铁是利用了一氧化碳的还原性,所以A处通入的气体为一氧化碳,而C仪器的名称为试管,为了验证是否生成了二氧化碳,所以在试管中应该装入的试剂为氢氧化钙溶液;
(2)炼铁的原理为用一氧化碳作为还原剂,在高温的条件下将铁还原出来,该反应生成了铁和二氧化碳,但是由于一氧化碳的利用率难以达到100%,所以为了防止有毒的一氧化碳直接排放到空气中,引起空气的污染,应该在最后加上尾气处理装置,而本题图中没有尾气处理装置;
(3)设获得11.2g铁需要三氧化二铁的质量为x,则:
Fe2O3+3CO
2Fe+3CO2 高温 .
160 112
x 11.2g
=160 112 x 11.2g
解得:x=16g
所以赤铁矿石中三氧化二铁的质量分数为:
×100%=80%.16g 20g
答:赤铁矿石中三氧化二铁的质量分数为80%.
故答案为:(1)CO; 试管;澄清石灰水(或Ca(OH)2溶液);
(2)Fe2O3+3CO
2Fe+3CO2;没有进行尾气处理; 高温 .
(3)80%.
