为了测定含杂质的氧化铁(杂质不参加反应)样品中氧化铁的质量分数,某同学称取该样品10g,并用如图所示的装置进行实验,得到如下两组数据:
| 反应前 | 氧化铁完全反应后 | |
| A组 | 玻璃管和样品的质量43.7g | 玻璃管和固体物质的质量41.3g |
| B组 | 广口瓶和澄清石灰水的质量180g | 广口瓶和瓶内物质的质量186.2g |
(1)①你认为,应当选择______组的数据来计算样品中的氧化铁的质量分数,请写出具体解题过程.②请解释你不选另一组数据进行计算的原因______.
(2)这位同学所用装置的不足之处是______.
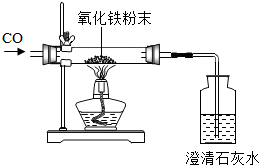
(1)①在加热的条件下,一氧化碳还原氧化铁生成了铁和二氧化碳,质量守恒定律,玻璃管和样品在反应前后减少的质量就是氧化铁中氧元素的质量,再根据氧化铁中氧元素的质量分数,可求出氧化铁的质量,进而可以求出氧化铁的质量分数.所以,可以用A组数据进行进行计算;
氧化铁中氧元素的质量为:43.7g-41.3g=2.4g
氧化铁的质量为:2.4g÷
=8g48 160
样品中的氧化铁的质量分数:
×100%=80%8g 10g
②在B组中由于氢氧化钙是微溶于水的,可能吸收生成二氧化碳不完全,不能用来进行计算;
(2)由于一氧化碳有毒,能污染空气.所以,这位同学所用装置的不足之处是缺少尾气回收装置.
故答为:(1)①A,解题过程见上边;②氢氧化钙是微溶于水的,可能吸收生成二氧化碳不完全;(2)缺少尾气回收装置.

