问题
问答题
某化学小组同学用一氧化碳还原氧化铁后的剩余固体做探究实验,过程如下:
(提出问题)该固体的成分是什么?
(查阅资料)①铁和硫酸铁反应的化学方程式是:Fe+Fe2(SO4)3═3FeSO4
②Fe2(SO4)3溶液为黄色,FeSO4溶液为浅绿色.
(作出猜想)该固体中含有铁粉和氧化铁
同学们猜想该固体含有氧化铁的依据是______.
(设计实验)
| 实验操作 | 实验现象 | 结论及相关化学方程式 | |
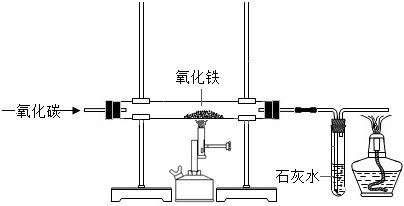
| 验证猜想 | 实验①取2g样品,放入玻璃管中,如图连接仪器,进行实验.
实验完毕,再称固体质量 | 现象一:____________ . 现象二: 反应后固体质量为1.88g,澄清石灰水增重0.3g | |
| 实验②另取2g样品放入试管中,加入少量稀硫酸. | 现象一:____________ ; 现象二: 生成浅绿色溶液. | ||
| 综合分析实验①、②现象,得出结论:猜想正确 | |||
答案
同学们猜想该固体含有氧化铁的依据是:一氧化碳没有把氧化铁完全还原
实验一即重新进行一氧化碳还原氧化铁实验,由于固体物质质量减少,石灰水变浑浊,证明原样品中确实含有氧化铁;实验二中,样品中含有铁,铁与硫酸反应有气体放出,产物为硫酸亚铁.
用“固体减重”计算更为准确,因为澄清石灰水浓度很小,很难将二氧化碳全部吸收,所以若用石灰水增重计算,结果可能会不准确.
故答案为:一氧化碳没有把氧化铁完全还原
| 粉末中的红色物质变为黑色,澄清石灰水变浑浊 | 3CO+Fe2O3═2Fe+3CO2 CO2+Ca(OH)2 剩余固体中有氧化铁 | ||||||
| 固体样品全部溶解,有气泡生成 | Fe+H2SO4═FeSO4+H2↑ Fe2O3+3H2SO4═Fe2(SO4)3+3H2O Fe+Fe2(SO4)3═3FeSO4 剩余固体中有铁粉 | ||||||
澄清石灰水浓度小,且试管中溶液质量小,对二氧化碳的吸收不充分