据元素周期表及周期律的知识回答下列问题:
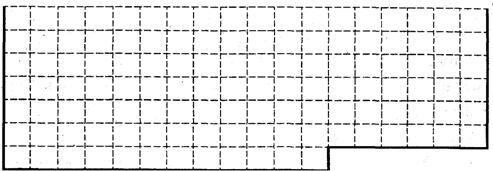
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.
(2)下列比较元素性质的递变规律正确的是______.
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式______.工业上可用MnSO4溶液吸收氯气,获得Mn2O3,请写出该化学反应的化学方程式______.
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱______.
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式______.
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是______.
(1)前36号元素为一~四周期元素,36号元素为氪,其用实线画出前36号元素所在的范围的边界,如图为
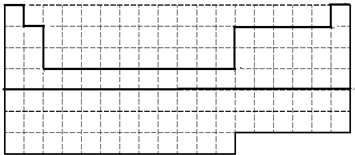 ,故答案为:
,故答案为: ;
;
(2)a.离子的电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->Cl->Na+>Mg2+,故a错误;
b.非金属性为Cl>S>P>Si,其最高价氧化物的水化物酸性为HClO4>H2SO4>H3PO4>H4SiO4,故b正确;
c.非金属性为O>S>P>Si,气态氢化物稳定性为H2O>H2S>PH3>SiH4,故c正确;
d.不易电离的氢化物,结合氢离子的能力强,则NH3结合H+的能力比H2O强,故d错误;
故答案为:bc;
(3)元素甲是第三周期ⅦA族元素,为Cl元素,与另两种非金属元素可组成离子化合物A,则A为NH4Cl,其电子式为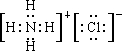 ,工业上可用MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,该反应为2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl,
,工业上可用MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,该反应为2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl,
故答案为: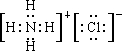 ;2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl;
;2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl;
(4)非金属性O>N,可利用得电子能力不同证明,如4NH3+5O2
2N2+6H2O或4NH3+5O2点燃 .
4NO+6H2O,催化剂 . △
故答案为:4NH3+5O2
2N2+6H2O或4NH3+5O2点燃 .
4NO+6H2O;催化剂 . △
(5)所有元素的气态氢化物中,元素乙的氢化物最稳定,乙为F,其单质与水反应生成HF和氧气,该反应为2F2+2H2O═4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(6)0.1mol的单质Cl2失去0.2mol电子,100mL1.5mol/L的FeBr2溶液,n(FeBr2)=0.15mol,亚铁离子还原性强,亚铁离子可全部被氧化,设被氧化的溴离子为x,由电子守恒可知,0.2mol=0.15mol+x×(1-0),解得x=0.05mol,所以被氧化的Fe2+和Br-的物质的量之比是0.15mol:0.05mol=3:1,故答案为:3:1.
