问题
填空题
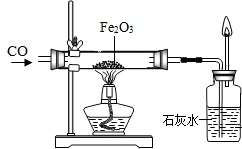
(1)在实验开始后可观察到如下现象:玻璃管中的粉末由______色逐渐变为______色,这说明了三氧化二铁在反应中失去了______而被还原,这种粉末就是被还原出来的______;澄清石灰水中出现______,这说明了一氧化碳夺取了三氧化二铁中的______而被氧化,产生了______气体.
(2)写出上述反应的有关化学方程式:
①______;②______.
若一氧化碳是足量的,要制得56g铁,需要三氧化二铁至少______g,同时能产生二氧化碳______g.
答案
(1)一氧化碳还原了氧化铁,粉末由红色的氧化铁变为黑色的单质铁,故答案为:红、黑、氧元素、铁粉
二氧化碳与澄清石灰水反应生成不溶于水的碳酸钙沉淀,故澄清石灰水变:浑浊.一氧化碳氧化成二氧化碳,故答案为:氧元素、CO2
(2)炼铁原理:3CO+Fe2O3
2Fe+3CO2 高温 .
CO2+Ca(OH)2=CaCO3↓+H2O
(3)设需要三氧化二铁的质量为X,生成二氧化碳的质量为Y
3CO+Fe2O3
2Fe+3CO2 高温 .
160 112 132
X 56 Y
160:112=X:56
X=80 (参与反应的物质的质量之比等于物质的式量之比)
112:132=56:Y
Y=66
故答案为:80克、66克
