现有含杂质的赤铁矿(主要成分为Fe2O3)样品,为了测定该样品中氧化铁的质量分数,某同学取该样品5.0g.该同学在实验室用一氧化碳还原赤铁矿(杂质不参加反应).装置示意图如下:
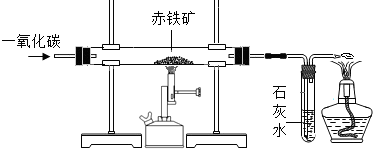
(1)在直形管内发生反应的化学方程式是:______.
(2)在盛有足量澄清石灰水试管的中里,发生反应的化学方程式是:______.
(3)样品充分反应后,测定实验数据,澄清石灰水增重3.3g.
(4)计算:
①反应生成CO2的质量是:______;②Fe2O3的相对分子质量是:______;
③10g赤铁矿中含氧化铁的质量是:______g;④该样品中氧化铁的质量分数是:______.
(1)由该实验可知,一氧化碳还原赤铁矿的反应中,反应物为CO和Fe2O3,由石灰水变浑浊及元素守恒,则生成物为Fe和CO2,
则反应的化学方程式为Fe2O3 +3CO
2Fe+3CO2,故答案为:Fe2O3 +3CO 高温 .
2Fe+3CO2; 高温 .
(2)因石灰水足量,则二氧化碳与氢氧化钙反应生成碳酸钙和水,即反应为Ca(OH)2 +CO2=CaCO3↓+H2O,故答案为:Ca(OH)2 +CO2=CaCO3↓+H2O;
(4)①由测定实验数据,澄清石灰水增重3.3g,可知石灰水增重是因吸收了二氧化碳的质量,即二氧化碳的质量为3.3g,故答案为:3.3g;
②由氧化铁的化学式为Fe2O3,其相对分子质量为56×2+16×3=160,故答案为:160;
③设5.0g样品中氧化铁的质量为xg,则
Fe2O3 +3CO
2Fe+3CO2, 高温 .
160 132
x 3.3g
=160 132
,解得x=4.0g,x 3.3g
即5.g样品中含有氧化铁的质量为4.0g,
则10.0g样品中含有氧化铁的质量为
×4.0g=8.0g,故答案为:8.0;10.0g 5.0g
④样品中氧化铁的质量分数为
×100%=80%,故答案为:80%.4.0g 5.0g
