右图为实验室研究炼铁的化学原理的装置,请回答和该实验有关的问题
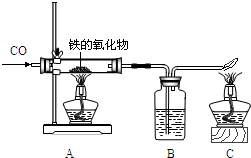
(1)A处玻璃管中发生反应的化学方程式为______
(2)B处的实验现象______
(3)C处酒精灯的作用______
(4)现有含杂质的氧化铁样品10克(杂质不参加反应),为测定该样品中氧化铁的质量分数,某同学用右图所示的装置进行实验,得到如下两组数据:
| 反应前 | 氧化铁完全反应后 | |
| 甲组 | 洗气瓶和石灰水的质量为190g | 洗气瓶和石灰水的质量为196g |
| 乙组 | 玻璃管和氧化铁样品的质量为57.9g | 玻璃管和氧化铁样品的质量为55.2g |
(1)A处玻璃管中发生反应的化学方程式为3CO+Fe2O3
2Fe+3CO2;高温 .
(2)二氧化碳能使澄清石灰水变浑浊,所以B处的实验现象是变浑浊;
(3)一氧化碳有毒,将其点燃可消除污染;
(4)选择乙组数据计算更为准确,玻璃管中固体减少的质量即为氧化铁中氧元素的质量,则氧化铁为:
=9g,样品中氧化铁的质量分数为:57.9g-55.2g 30%
×100%=90%;9g 10g
故答案为:(1)3CO+Fe2O3
2Fe+3CO2;高温 .
(2)变浑浊;
(3)点燃CO,消除其污染;
(4)乙、90%

