问题
实验题
实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气。
(1)查阅资料。20 ℃时不同质量分数硫酸的密度(g/mL)

分析以上数据,可得出结论。(写两条)
①__________________________
②__________________________
(2)计算。配制200g24.5%的稀硫酸,需______g98%的浓硫酸和_________g水。实验操作时,取98%的浓硫酸_________mL(精确到1mL)。
(3)配制稀硫酸。分别用量筒量取所需的水和浓硫酸,先将____ 倒入烧杯中,然后____。
(4)制取氢气。
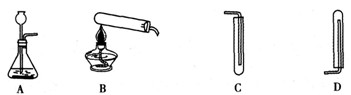
①下图中可用于制取、收集氢气的装置是____ (填字母);
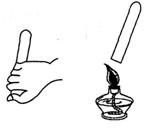
②检验氢气纯度的方法如图所示,表明氢气不纯的现象是_____________________。
答案
(1)①硫酸溶液中溶质的质量分数越大,溶液的密度越大
②硫酸溶液的密度比纯水的密度大
(2)50;150;27
(3)水;将浓硫酸沿着烧杯壁慢慢注入水中,并不断用玻璃棒进行搅拌
(4)①AD
②听到尖锐的爆鸣声
