某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分.仪器中盛放的试剂为:a-无水乙醇(沸点:78℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液.
(1)简述两套方案各自的优点:
甲______
乙______.
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为______(例如甲①,乙②)
(3)若要保证此实验有较高的效率,还需补充的仪器有______.
理由______.
(4)实验中能验证乙醇氧化产物的实验现象是______.
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式______.
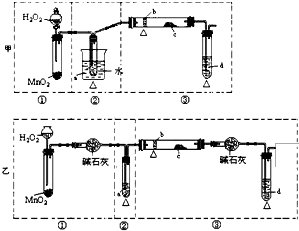
(1)甲中用分液漏斗,而乙中是长颈漏斗,用分液漏斗可以控制液体的流量,控制反应的进行,甲采用水浴加热,可形成较平稳的乙醇气流,使反应更充分,而乙中不是,甲中的②装置采用斜、长导管,斜、长导管起到冷凝回流乙醇蒸汽的作用 但是乙中没有,在乙装置中,①③两处用了干燥管,可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证,但是甲中没有,
故答案为:甲:①中用分液漏斗可以控制液体的流量,控制反应的进行;②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜、长导管起到冷凝回流乙醇蒸汽的作用 (三点中答出两点即可);乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证;
(2)根据两套装置的优点来组装新的仪器装置为:乙①;甲②;乙③,故答案为:乙①;甲②;乙③;
(3)无水乙醇的沸点是78℃,要保证此实验有较高的效率,应注意温度的控制,保证乙醇以蒸汽形式去参与反应,可以控制水浴温度在78℃或略高于78℃,使乙醇蒸汽平稳流出,减少挥发,
故答案为:温度计;控制水浴温度在78℃或略高于78℃,使乙醇蒸汽平稳流出,减少挥发,提高反应效率;
(4)乙醇催化氧化产物是乙醛,属于醛类,可以和氢氧化铜悬浊液反应生成砖红色沉淀和水,
故答案为:c处无水硫酸铜变蓝,d处生成红色沉淀;
(5)装置中,若撤去第①部分,则无氧气存在时,乙醇会在催化剂作用下分解为乙醛和氢气,
即C2H5OH
CH3CHO+H2↑,故答案为:C2H5OHCu △
CH3CHO+H2↑.Cu △
