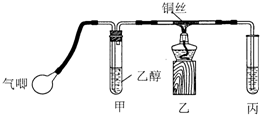
某课外活动小组利用图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时先加热玻璃管中的铜丝,约lmin后鼓入空气.请填写下列空白:
(1)乙醇发生催化氧化反应的化学反应方程式为______.
(2)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是______;由于装置设计上的缺陷,实验进行时可能会______.
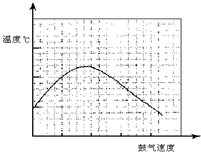
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示.试解释出现图中现象的原因:______该实验中“鼓气速度”这一变量可用______来计量.
(1)乙醇在通作催化剂时,可以被氧气氧化为乙醛,反应的方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,Cu △
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;Cu △
(2)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀,导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象,故答案为:使生成乙醇蒸气的速率加快且较均匀;发生倒吸;
(3)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来,故答案为:鼓气多反应放热多,过量的气体会将体系中的热量带走;单位时间内甲中的气泡数.
