(1)氮元素基态原子核外未成对电子数为______个;
(2)C、N、O三种元素第一电离能从大到小的顺序是______;
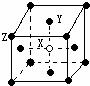
(3)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个顶点,该晶体中X、Y、Z的粒子个数比为______;
(4)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式______;葡萄糖分子中碳原子杂化方式有______.
(5)某化合物其组成可用CoCl3•5NH3表示.把CoCl3•5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀.经测定,每1molCoCl3•5NH3只生成2molAgCl.请写出表示此配合物结构的化学式(钴的配位数为6)______.
(1)N元素基态原子核外电子排布式为1s22s22p3,3个电子在三个轨道中排布,故未成对电子数为3个,故答案为:3;
(2)同周期元素从左到右元素的第一电离能逐渐增大,由于N2p轨道为半饱和状态,较为定,难以失去电子,则C、N、O三种元素第一电离能从大到小的顺序是N>O>C,故答案为:N、O、C;
(3)X位于体心,则晶胞中含有1个X,Y位于面心,共4个,则晶胞中Y4×
=2个,Z为与顶点,则有8×1 2
=1个,三者比值为1:2:1,1 8
故答案为:1:2:1;
(4)Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
(5)每1molCoCl3•5NH3只生成2molAgCl,说明能电离出2molCl-,则Co离子的配位数应为6,配体分别为5个NH3和1个Cl-,则此配合物结构的化学式:[Co(NH3)5Cl]Cl2,
故答案为:[Co(NH3)5Cl]Cl2.
