(1)配制100g质量分数为5%的氢氧化钠溶液,需要氢氧化钠固体______g;称量时出现了右盘低的现象,接下来的操作应该是______.
(2)量取水时,如果按照图①的方法读数,会使配制的溶液溶质质量分数______(填“偏大”或“偏小”);②中用玻璃棒搅拌的作用是______.
(3)配制好的氢氧化钠溶液要密封保存,原因是______(用化学方程式表示),小明欲检验某氢氧化钠样品是否完全变质,需用的试剂是______.
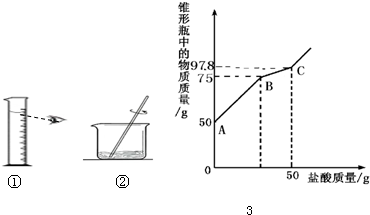
(4)小方取变质的氢氧化钠固体样品10.0g于锥形瓶中,加入40.0g水,振荡形成溶液,向锥形瓶中逐滴滴加14.6%的稀盐酸,实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图3所示.经计算测得
①样品中含有______物质,
②10.0g样品中碳酸钠的质量(写出计算过程)
(1)根据溶质质量=溶液质量×溶质质量分数;配制100g质量分数为5%的氢氧化钠溶液,需要氢氧化钠固体:100g×5%=5g;称量时出现了右盘低的现象,说明氢氧化钠还不足5g,接下来的操作应该是继续添加氢氧化钠直至天平平衡;
(2)量取水时,仰视时量取的水要多,故会使配制的溶液溶质质量分数偏小;②中用玻璃棒搅拌的作用是搅拌,加速溶解;
(3)氢氧化钠易吸收二氧化碳而变质,反应的方程式为:2NaOH+CO2=Na2CO3+H2O;欲检验某氢氧化钠样品是否完全变质,需用的试剂是:氯化钙和无色酚酞溶液.
(4)①由图示可知样品中含有氢氧化钠、碳酸钠;
②由题意和坐标分析可知,曲线第一段物质增加的质量就是与氢氧化钠反应的盐酸的质量,即75g-50g=25g
设与盐酸反应的氢氧化钠的质量为x
HCl+NaOH=NaCl+H2O
36.5 40
25g×14.6% x
=36.5 25g×14.6% 40 x
x=4g;
因此碳酸钠的质量为:10g-4g=6g
答:10.0g样品中氢氧化钠的质量是4g,碳酸钠的质量是6g.
