(16分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足:
_____________________________________________________________________
Ⅱ.课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:
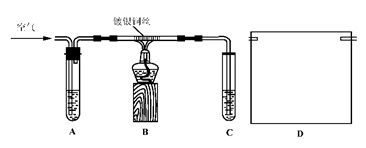
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________________;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是:________________________________________________________;
Ⅲ.课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将A装置浸在70~80℃的水浴中,目的是____________________________;
②装置B、C之间接上D装置,请你在上面方框中,画出D的装置图。
(4)如果在装置B、C之间不增加D装置,提出你对实验改进的意见:
。
Ⅰ.操作麻烦、乙醇转化率低 (2分)
Ⅱ.(2)①放热(2分)
2CH3CH2OH+O2 2CH3CHO+2H2O(2分)
2CH3CHO+2H2O(2分)
②观察甲中单位时间内的气泡数(2分)
Ⅲ.(3)①使生成乙醇蒸汽的速率加快(2分)
②见下图 (2分)

(4)将试管C浸在冰水中,产物不用水吸收而是直接冷却 (2分)
Ⅰ.这样虽然可以生成乙醛,但效率太低,且操作麻烦。
Ⅱ.(2)铜丝能长时间保持红热直到实验结束,说明反应是放热反应,放出的热量足以维持反应的进行。乙醇被氧化生成是乙醛,反应式为2CH3CH2OH+O2 2CH3CHO+2H2O。
 要控制气体的流速,可以通过察甲中单位时间内的气泡数来实现。
要控制气体的流速,可以通过察甲中单位时间内的气泡数来实现。
Ⅲ.(3)由于温度越高,乙醇的挥发酸度越快,所以将A装置浸在70~80℃的水浴中。由于乙醛或乙醇都是和水互溶的,所以直接插入到水中,容易引起溶液的倒流,所以应该加1个防倒吸的装置。如果不加防倒吸的装置,则不能直接用水吸收,而应该将试管C浸在冰水中直接冷却,以得到液态的乙醛。
