CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2•2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。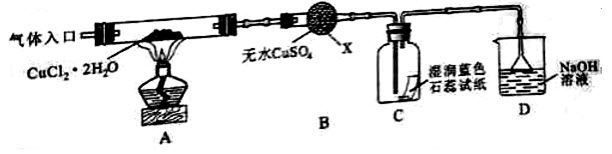
请回答下列问题:
(1)仪器X的名称是()。
(2)实验操作的先后顺序是a→()→c(填操作的编号)
a.检查装置的气密性后加入药品b.熄灭酒精灯,冷却
c.在“气体入口”处干燥HCld.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是()。
(4)装置D中发生的氧化还原反应的离子方程式是()。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是()。
②若杂质是CuO,则产生的原因是()。
参考答案:
(1)干燥管
(2)c;d;b
(3)先变红,后褪色
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5)①加热时间不足或温度偏低②通入HCl的量不足
解析:

(3)B中有白色变为蓝色,说明有水生成,产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色,答案为:先变红,后褪色。
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,答案为:Cl2+2OH-=Cl-+ClO-+H2O。

考点:元素及化合物知识、化学实验等
