实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数。
(1)配制100g质量分数为5%的氢氧化钠溶液,需要10%的氢氧化钠溶液 g。
(2)配制氢氧化钠溶液时,需要的玻璃仪器有 、滴管、烧杯、玻璃棒。
(3)用配得的氢氧化钠溶液与待测溶质质量分数的硫酸溶液反应,实验过程中溶液的pH变化曲线如图所示:
①根据如图变化曲线,判断进行的操作是 (填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②b点对应的溶液中的溶质为 (写化学式)。
(4)若完全中和50g稀硫酸溶液,恰好消耗配得的氢氧化钠溶液80g,试计算该稀硫酸的溶质质量分数(请写出计算过程)
(1)50;(2)量筒;(3)①B;②Na2SO4、NaOH;(4)9.8%
题目分析:(1)根据稀释前后溶质不变考虑。设需要10%的氢氧化钠溶液质量为X则:100g×5%=X×10%解得X=50g;
(2)量取水时需要的玻璃仪器有量筒、胶头滴管,溶解时需要的玻璃仪器有烧杯、玻璃棒,因此缺少玻璃仪器是量筒;
(3)①曲线所示,反应后溶液的酸碱度逐渐增大,说明此实验是把氢氧化钠溶液逐滴加入硫酸溶液中,而使溶液的酸碱度逐渐增大;故为B;
②b点溶液酸碱度大于7,说明滴加的氢氧化钠过量,因此溶液为硫酸钠与氢氧化钠的混合溶液,其溶质为Na2SO4 、NaOH;
(4)根据反应的化学方程式,由恰好完全反应消耗氢氧化钠的质量,计算所消耗50g硫酸溶液中硫酸的质量,求得该硫酸溶液中溶质的质量分数。设该稀硫酸中溶质的质量为x
2NaOH+H2SO4 =Na2SO4 +2H2O
80 98
80g×5% X
根据: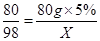
解得X=4.9g
该稀硫酸的溶质质量分数为: ×100%=9.8%
×100%=9.8%
答:待测硫酸的质量分数为9.8%
