溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
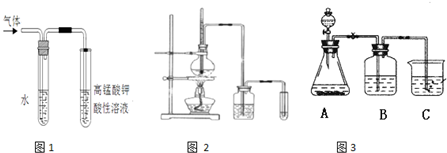
反应类型______.某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:______.
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式______反应类型______.反应中生成的气体可以用图1所示装置检验,现象是______,水的作用是______.除高锰酸钾酸性溶液外,还可以用______检验生成的气体,此时还有必要将气体先通入水中吗?______(填“有”或“没有”)
图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式______,反应类型______;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:______;
(3)为了检验乙烯的生成,试管中应盛放______,现象为______;
(4)洗瓶中盛放的试剂为______,作用______
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:______;
(2)C中的现象为______,写出C中反应的化学方程式:______
(3)B中的试剂为______,作用______.
(Ⅰ)(1)卤代烃在碱性水溶液加热条件下发生取代反应,由溴乙烷变成乙醇,生成乙醇与溴化钠方程式为CH3CH2Br+NaOH
CH3CH2OH+NaBr,检验溴乙烷中含有溴元素,卤代烃水解后,加入硝酸酸化的硝酸银,硝酸酸化目的中和碱,否则生成氢氧化银沉淀,氢氧化钠/水 加热
故答案为:取代;不合理没有用硝酸中和氢氧化钠溶液;
(2)卤代烃在碱性醇溶液加热条件下发生了消去反应,生成不饱和烯烃,CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr,乙烯气体不溶于水,高锰酸钾能氧化乙烯,所以,它能使高锰酸钾溶液褪色,溴的四氯化碳溶液能和乙烯发生加成反应,所以,乙烯也能使溴水褪色,因装置1中用水,目的是防止乙醇和高锰酸钾反应,而溴与乙醇不反应,所以,无须用水;醇 加热
故答案为:CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr;消去反应;溶液褪色; 吸收乙醇; 溴的四氯化碳溶液; 没有;醇 加热
(Ⅱ)(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,故答案为:CH3CH2OH
CH2=CH2↑+H2O;浓硫酸 170℃
故答案为:CH3CH2OH
CH2=CH2↑+H2O; 消去反应;浓H2SO4 170℃
(2)乙醇被浓硫酸氧化成碳,碳被浓硫酸氧化成二氧化碳,硫酸被还原成二氧化硫,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O; △ .
(3)高锰酸钾具有强氧化性,乙烯含有不饱和键,C=C双键,能被高锰酸钾溶液氧化,C=C双键,能卤素单质发生加成反应,乙烯易和溴加成生成1,2-二溴乙烷,
故答案为:高锰酸钾溶液(或溴的四氯化碳溶液); 溶液褪色;
(4)二氧化硫与高锰酸钾溶液反应,所以用NaOH溶液除去SO2,CO2,SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O
故答案为:氢氧化钠溶液; 吸收SO2CO2;
(Ⅲ) (1)盐酸和碳酸钠反应生成二氧化碳,根据强酸制取弱酸的原则,证明酸性:盐酸>碳酸,
故答案为:CO32-+2H+=H2O+CO2↑
(2)苯酚钠中通入二氧化碳反应生成碳酸氢钠和苯酚,C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,苯酚在冷水中溶解度小,产生白色浑浊现象,
故答案为:白色浑浊;C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(3)盐酸和碳酸氢钠反应,碳酸氢钠和二氧化碳不反应,所以,盛有饱和NaHCO3溶液的洗气B装置,目的是将二氧化碳中的氯化氢洗去,防止氯化氢与苯酚钠反应,
故答案为:饱和碳酸氢钠溶液; 吸收CO2中的HCl;
