问题
填空题
[选修3——物质结构与性质]
Ⅰ(6分)
下列叙述正确的有()。
A.第四周期元素中,锰原子价电子层中未成对电子数最多
B.第二周期主族元素的原子半径随核电荷数增大依次减小
C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小
Ⅱ(14分)
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为(),晶体中原子间通过()作用形成面心立方密堆积,其中M原子的配位数为()。
(2)元素Y基态原子的核外电子排布式为(),其同周期元素中,第一电离能最大的是()(写元素符号)。元素Y的含氧酸中,酸性最强的是()(写化学式),该酸根离子的立体构型为()。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
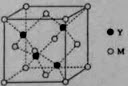
①该化合物的化学式为(),已知晶胞参数a=0.542nm,此晶体的密度为()g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是()。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为()。
答案
参考答案:
Ⅰ:BD
Ⅱ:
(1)金属晶体;金属键;12
(2)1s22s22p63s23p5;Ar;HClO4;正四面体
(3)①CuCl;
②Cu+可与氨形成易溶于水的配位化合物(或配离子);[Cu(NH3)4]2+
