铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为:______.
(2)SO42-中硫原子的杂化轨道类型是______:写出一种与SO42-互为等电子体的分子______.
(3)某反应在超细铜粉做催化剂作用下生成
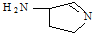
,则分子中σ键与π键之比为______
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有______.(填字母)
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为______.
(6)铜的某氯化物的晶胞结构如图
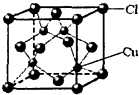
所示,该化合物的化学式为______.
(1)N、O元素属于同一周期,且N元素属于第VA族,O元素属于第VIA族,O、S属于同一周期,且S元素的原子序数大于O元素,所以第一电离能大小顺序是N>O>S,故答案为:N>O>S;
(2)SO42-中S原子的价层电子数=4+
(6+2-3×2)=4,所以采取杂sp3化方式,原子个数相等且价电子数相等的微粒为等电子体,与SO42-互为等电子体的分子为CCl4,1 2
故答案为:sp3,CCl4;
(3)共价单键是σ键,共价双键中一个是σ键一个是π键,该物质中含有14个σ键1个是π键,所以分子中σ键与π键之比为14:1,故答案为:14:1;
(4)[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键,故选ACE;
(5)NH4CuSO3中的金属阳离子是Cu+,基态Cu+核外有28个电子,根据构造原理知其核外电子排布式为:1S22S22P63S23P63d10或[Ar]3d10,故答案为:1S22S22P63S23P63d10或[Ar]3d10;
(6)该晶胞中铜原子个数是4,氯原子个数=8×
+6×1 8
=4,所以其化学式为:CuCl,故答案为:CuCl.1 2
