研究性学习小组进行溴乙烷的制备及性质探究实验.
探究一:该小组制备溴乙烷的步骤如下:
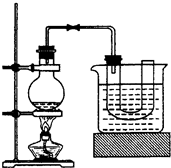
①向装置图所示的U形管和大烧杯中加入冷水;②在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;③向装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;④将冷却至室温的混合液转移到圆底烧瓶中,加热;⑥制取溴乙烷.同答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:______
(2)步骤④加热片刻后,烧瓶内的混合物出现橘红色,出现这种现象的原因是(请用化学反应方程式表示)______.改用小火加热后,橘红色会逐渐消失,消失的原因是(请用化学反应方程式表示)______
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是______.
(4)步骤⑤反应结束后,将U形管中的混合物用______方法得到粗产品.除去粗产品中的杂质,可用下列试剂中的______,
A.氢氧化钠稀溶液 B.碳酸钠稀溶液
C.硝酸银溶液 D.四氯化碳
探究二:溴乙烷与NaOH乙醇溶液的反应.学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.
| 所用试剂操作方法 | 实验现象 | |
| 1 | ||
| 2 |
(1)乙醇易挥发,且温度越高挥发越剧烈.当将浓硫酸缓缓加入到水和乙醇的混合液中,会放出大量的热,把小烧杯放在冷水中冷却,可有效地控制混合液的温度上升,从而防止乙醇挥发,故答案为:防止乙醇挥发;
(2)浓H2SO4具有强氧化性,而Br-具有较强还原性,相互之间会发生反应2HBr+H2SO4(浓)
Br2+SO2↑+2H2O(或2NaBr+3H2SO4(浓) 加热 .
Br2+SO2↑+2NaHSO4+2H2O)而生成Br2,Br2溶于混合液中而使烧瓶内的混合物出现橙红色.当改用小火加热时,生成Br2的速率变慢,且Br2又与水反应Br2+H2O═HBr+HBrO而被消耗,使得混合液的橙红色逐渐消失,故答案为:2HBr+H2SO4(浓) 加热 .
Br2+SO2↑+2H2O(或2NaBr+3H2SO4(浓) 加热 .
Br2+SO2↑+2NaHSO4+2H2O);Br2+H2O=HBrO+HBr; 加热 .
(3)题干中叙述是小火加热,说明反应所需温度较低,则可用水浴加热,故答案为:水浴加热;
(4)产物溴乙烷的密度较大,与混合液分层后,它处于下层,为了制取溴乙烷,则应弃去上层液体.粗产品中存在酸性杂质,应用碱性物质除掉,但强碱NaOH会促进溴乙烷的水解,则用碳酸钠的稀溶液来除杂,故答案为:分液;B;
探究二:该条件下溴乙烷应发生消去反应而生成乙烯.检验乙烯可根据其能使酸性KMnO4溶液及溴水褪色的原理来进行,可以采用洗气的装置,观察到酸性KMnO4溶液褪色且有气泡产生,溴水或溴的四氯化碳溶液褪色即可.故答案为:

.
