问题
填空题
以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KCLO3的流程如下:
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为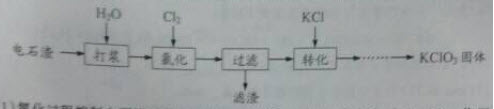 。
。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有()(填序号)。
A.适当减缓通入Cl2速率B.充分搅拌浆料C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为()
6Ca(OH)2+6Cl2======Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。
①渣的主要成分为()(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]()1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO2,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是()。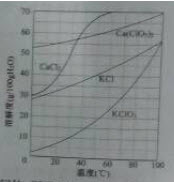
答案
参考答案:
(1)①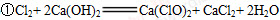 ②AB
②AB
(2)①CaCO3、Ca(OH)2 ②<
(3)蒸发浓缩、冷却结晶
