实验室制取溴乙烷的反应如下:NaBr+H2SO4====NaHSO4+HBr,CH3CH2OH+HBr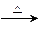 CH3CH2Br+H2O。已知反应物的用量NaBr(s)0.3mol,乙醇0.25 mol,浓硫酸36 mL(98%,密度1.84 g·cm-3),水25 mL,其中乙醇的密度约为水的密度的4/5,试回答:
CH3CH2Br+H2O。已知反应物的用量NaBr(s)0.3mol,乙醇0.25 mol,浓硫酸36 mL(98%,密度1.84 g·cm-3),水25 mL,其中乙醇的密度约为水的密度的4/5,试回答:
(1)反应时,若温度过高,可有红棕色气体产生,写出反应的化学方程式:_____________________________________。
(2)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是____________,必须使用的仪器是__________________。
(3)本实验的产率为60%,则可制取溴乙烷____________g。
(1)2HBr+H2SO4(浓)====Br2↑+SO2↑+2H2O
(2)稀NaOH溶液 分液漏斗
(3)16.35
(1)若温度过高,浓硫酸会将生成的HBr氧化为溴蒸气,而使产生的气体呈红棕色。
(2)棕黄色的粗溴乙烷中混有少量的液态溴,可用NaOH溶液多次洗涤,然后分液。
(3)NaBr—HBr—C2H5OH—C2H5Br,HBr过量,则:m(C2H5Br)="0.25" mol×109 g·mol-1×60%="16.35" g。
