已知部分短周期元素的性质及原子结构如下表所示,X~M的原子序数依次增大.
| 元素代号 | 原子结构或元素性质 |
| X | 最高正价=|最低负价| |
| Y | 原子核及核外各层电子的排布情况如图: |
| Z | 原子结构示意图: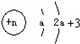 |
| L | 原子半径为同周期主族元素中最大 |
| M | 其原子序数比L大2 |
(1)Y的元素符号为______,X的最高氧化物的化学式为______.
(2)Z、L、M元素的简单离子半径由大到小的顺序为______(用离子符号表示).
(3)写出M元素的最高价氧化物与L元素的最高价氧化物对应的水化物反应的化学方程式:______.
X元素最高正价=|最低负价|,说明X位于第IVA族;
Y原子核及核外各层电子的排布情况如图: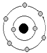 ,Y原子核外电子数为8,则Y为O元素,X的原子序数小于Y,所以X为C元素;
,Y原子核外电子数为8,则Y为O元素,X的原子序数小于Y,所以X为C元素;
Z原子结构示意图: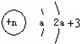 ,K电子层最多排列2个电子,所以a=2,L电子层电子数为7,则Z原子核外有9个电子,为F元素;
,K电子层最多排列2个电子,所以a=2,L电子层电子数为7,则Z原子核外有9个电子,为F元素;
L原子半径为同周期主族元素中最大,且该元素为短周期元素,其原子序数大于F元素,所以L为Na元素;
M原子序数比L大2,则M元素为Al元素,
(1)Y的元素符号为O,X的最高氧化物为二氧化碳,二氧化碳的化学式为CO2,故答案为:O;CO2;
(2)Z、L、M元素分别是F、Na、Al元素,这三种元素形成的简单离子电子层结构相同,电子层结构相同的离子其离子半径随着原子序数的增大而减小,所以这三种元素的简单离子半径由大到小的顺序为F->Na+>Al3+,
故答案为:F->Na+>Al3+;
(3)M元素的最高价氧化物为Al2O3,L元素的最高价氧化物对应的水化物为NaOH,氢氧化钠溶液和氧化铝反应生成偏铝酸钠和水,所以反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O.
