〔化学—选修2:化学与技术〕(15分)
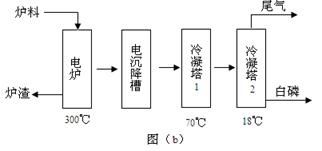
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
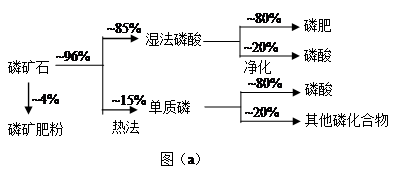
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
(1)69; (2) Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;0.49;(3)CaSiO3;液态白磷;固态白磷;(4)SiF4、CO;SiF4、HF、 H2S ;PH3 (5)产品纯度大(浓度大)
题目分析:(1)根据图示可知生产含磷肥料,约占磷矿石使用量的比例是0.04+0.96×0.85×0.80="0.69." (2)以磷灰石为原料,用过量的硫酸溶解Ca3F(PO4)3,可制得磷酸。根据质量守恒定律可得反应的化学方程式为Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;根据P守恒可得关系式 P2O5~2H3PO4.142份P2O52可制取196份的磷酸。1吨折合含有五氧化二磷约30%的磷灰石,含有P2O5的质量是0.3吨,所以可制取85℅的商品磷酸是质量是(196×0.3t)÷142÷0.85="0.49t;(3)" 二氧化硅、过量焦炭与磷灰石混合,在高温下反应除了得到白磷外,得到的难溶性的固体物质是CaSiO3;冷凝塔1的温度是70℃,280. 5℃>t>44℃所以此时主要沉积物是液态白磷;冷凝塔2的温度是12℃,低于白磷的熔点,故此时主要沉积物是固态白磷。(4)根据题目提供的信息,结合反应实际,在尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液, SiF4、HF、 H2S会与碳酸钠反应而除去;再通入次氯酸钠溶液,由于次氯酸钠有强氧化性,因此可除去有还原性的PH3 。(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高。但是产品纯度大,杂质少,因此逐渐被采用。
