(其中(1)题每空1分,(2)、(3)、(4)每空2分,共14分)
现有下列十种物质:①NH3 ②铁 ③Ba(OH)2 ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 氧化物 | 电解质 | 非电解质 | |||
| 属于该类的物质 | ② | ⑧ ⑨ | ⑦ |
 H2O,该离子反应对应的化学方程式(写一个)为
H2O,该离子反应对应的化学方程式(写一个)为 (3)⑩在水中的电离方程式为 ,17.1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为 。
(4)将④通入⑥的溶液中反应的离子方程为 。
(第(1)问每空1分,其余每空2分共14分)(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧ ⑨ | ⑦ | ③⑤ ⑥ ⑩ | ①④ |
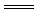 Na2SO4 + 2H2O (答案合理即可)
Na2SO4 + 2H2O (答案合理即可)(3)0.6mol/L Al2(SO4)3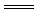 2Al3++ 3SO42- (4)CO2+2OH-=CO32- + H2O 或CO2+OH‑=HCO3_
2Al3++ 3SO42- (4)CO2+2OH-=CO32- + H2O 或CO2+OH‑=HCO3_
题目分析:(1)铁是单质,CO2是氧化物,氨水和稀硝酸都是溶液,⑦是氢氧化铁胶体。溶于水或在熔融状态下,能够导电的化合物是电解质,则③⑤⑥⑩都是电解质。溶于水和在熔融状态下,都不能够导电的化合物是非电解质,则①④是非电解质。
(2)根据离子反应:H++OH-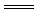 H2O可知,该反应应该是强酸与强碱之间的反应,所以符号条件的是2NaOH+H2SO4
H2O可知,该反应应该是强酸与强碱之间的反应,所以符号条件的是2NaOH+H2SO4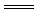 Na2SO4 + 2H2O或氢氧化钠与稀硝酸,或氢氧化钡与稀硝酸,但不能是氢氧化钡与稀硫酸。
Na2SO4 + 2H2O或氢氧化钠与稀硝酸,或氢氧化钡与稀硝酸,但不能是氢氧化钡与稀硫酸。
(3)硫酸铝在溶液中完全电离,电离方程式是Al2(SO4)3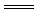 2Al3++ 3SO42-。17.1g硫酸铝的物质的量是17.1g÷342g/mol=0.05mol,则溶液中SO42-的物质的量浓度为0.15mol÷0.25L=0.6mol/L。
2Al3++ 3SO42-。17.1g硫酸铝的物质的量是17.1g÷342g/mol=0.05mol,则溶液中SO42-的物质的量浓度为0.15mol÷0.25L=0.6mol/L。
(4)CO2是酸性氧化物,能和氢氧化钠溶液反应生成碳酸钠或碳酸氢钠,方程式是CO2+2OH-=CO32- + H2O、CO2+OH‑=HCO3_。
点评:该题是中等难度的试题,也是高考中的常见考点。试题基础性强,侧重对学生基础性知识对巩固与检验,同时兼顾对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力和应试能力。
