Ⅰ.(6分)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据()。
(2)用离子方程式表示除去固体产物中Al2O3的原理()。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理()。
Ⅱ.(12分)磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
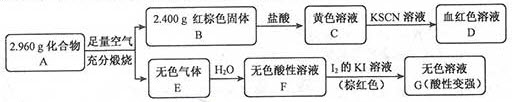
请回答:
(1)A的组成元素为()(用元素符号表示),化学式为()。
(2)溶液C可溶解铜片,例举该反应的一个实际应用()。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g·L-1),该气体分子的电子式为()。写出该反应的离子方程式()。
(4)写出F→G反应的化学方程式()。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)()。
参考答案:
Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)Al2O3+2OH−═2AlO2−+H2O
(3)MgO+2NH4Cl+H2O═MgCl2+2NH3·H2O
或NH4Cl+H2O≒NH3·H2O+HCl,MgO+2HCl═MgCl2+H2O
Ⅱ.(1)S、Fe;Fe3S4
(2)制印刷电路板
(3)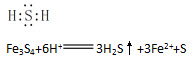
(4)H2SO3+I2+H2O═H2SO4+2HI
取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42−,过量后去滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。
