问题
填空题
(1)D3+的3d亚层为半充满,其基态原子的价电子排布图为______
(2)①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的π键数目为______.
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型有______;分子中处于同一直线上的原子数目最多为______.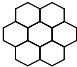
(3)石墨的片层结构如图所示,试回答:
①平均______个碳原子构成一个正六边形;
②石墨晶体每一层碳原子数与C-C化学键之比为______;
③12g碳原子可构成______个正六边形.
答案
(1)D3+的3d亚层为半充满的元素是Fe元素,Fe原子价层电子为3d64s2,其价电子排布图为: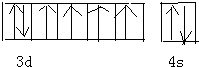 ,
,
故答案为: ;
;
(2)①根据等电子体原理可知,O22+的电子式 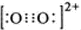 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
故答案为: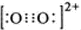 ;2NA;
;2NA;
②通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;故答案为:sp杂化、sp2杂化;3;
(3)①一个正六边形含有碳原子个数=6×
=2,1 3
故答案为:2;
②一个碳原子含有的碳碳键个数=
×3=1.5,所以碳原子个数和碳碳键个数比=1:1.5=2:3,1 2
故答案为:2:3;
③一个正六边形含有碳原子个数=6×
=2,12g碳原子的个数是NA个,所以能形成正六边形个数=1 3
=0.5NA,NA 2
故答案为:0.5NA.
