问题
问答题
粗盐中含有氯化镁、硫酸钠等可溶性杂质和泥沙等难溶性杂质.某研究小组为了从粗盐中提取纯净的食盐,设计了如下的实验:为了使粗盐中的氯化镁、硫酸钠等杂质完全转化为沉淀,所以加入的每种试剂均过量;已知白色沉淀A能溶于酸,而白色沉淀B不溶于硝酸.
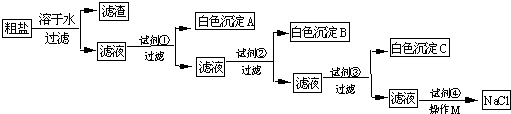
(1)试剂①是一种可溶性碱,那么白色沉淀A是______,试剂②是______,
(2)加入试剂④发生反应的化学方程式是:______.
(3)操作M是______.
答案
(1)试剂①是一种碱,且所得白色沉淀A能溶于酸,则加入的是NaOH溶液,目的是与除去MgCl2,反应生成Mg(OH)2沉淀和氯化钠;白色沉淀B不溶于硝酸,所以加入的试剂②是BaCl2,目的是除去Na2SO4;
故答案为:Mg(OH)2;BaCl2;
(2)加入过量的氯化钡溶液除去硫酸钠,再加入过量的碳酸钠溶液除去氯化钡,最后所得滤液中含有过量的氢氧化钠和碳酸钠溶液,再加入适量的稀盐酸把碳酸钠和氢氧化钠除去,所以加入试剂④发生反应的化学方程式是:NaOH+HCl═NaCl+H2O Na2CO3+2HCl═2NaCl+H2O+CO2↑;
故答案为:NaOH+HCl═NaCl+H2O Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)加入试剂④后得到的溶液蒸发结晶,即可得氯化钠晶体;
故答案为:蒸发结晶.
