问题
填空题
粗盐中含有MgCl2、CaCl2等杂质,必须进行分离和提纯后才能用于工业生产和人们的日常生活.粗盐提纯的部分流程如下图:
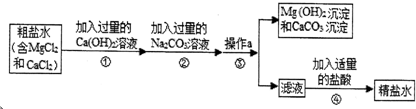
请回答:
(1)步骤②加入过量的碳酸钙溶液的目的是______,反应的化学方程式为______;
(2)步骤④加入适量盐酸的目的是______;
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有______(填化学式).
答案
(1)加入过量的碳酸钠溶液可以把氯化钙和氢氧化钙完全除去,反应的化学方程式分别为:CaCl2+Na2CO3═CaCO3↓+2NaCl、Na2CO3+Ca(OH)2═CaC03↓+2NaOH.
故填:CaCl2+Na2CO3═CaCO3↓+2NaCl、Na2CO3+Ca(OH)2═CaC03↓+2NaOH.
(2)步骤④加入适量盐酸可以把过量的碳酸钠和生成的氢氧化钠除去.
故填:除去过量的碳酸钠和生成的氢氧化钠.
(3)若步骤①和步骤②的顺序颠倒,则氢氧化钙和氯化镁反应生成的氯化钙在以后的过程中无法除去,最后形成的溶液中含有氯化钠、氯化钙,氯化钙的化学式是CaCl2.
故填:CaCl2.
