问题
计算题
(10分)将5%的NaOH溶液逐滴加入到10g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。边回答:
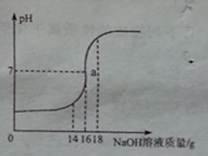
(1)a点溶液中大量存在的离子有______________。
(2)当恰好完全反应时,消耗NaOH溶液的质量为__________。
(3)计算稀盐酸中溶质的质量分数。
答案
(1)钠离子、氯离子(Na+、Cl—)
(2)16g。
(3)7.3%。
题目分析:(1)题目中的的反应为氢氧化钠与盐酸反应生成氯化钠和水。根据题意可知:a点表示加入的氢氧化钠过量。所以溶液中含氢氧化钠(过量)和反应生成的氯化钠;则含钠离子、氢氧根离子和氯离子。其中氢氧根离子的量较小。所以应为钠离子和氯离子。
(2)当恰好完全反应时,溶液呈中性,PH等于7。此时消耗NaOH溶液的质量为16g。
(3)已知量为加入的氢氧化钠的质量,未知量为稀盐酸中溶质的质量分数。解题思路:可根据氢氧化钠与纯盐酸的质量关系进行求解。具体过程如下:
解:加入氢氧化钠的质量为16g×5%=0.8g
设稀盐酸中溶质的质量分数为x
HCl+NaOH==NaCl+H2O
36.5 40
10gx 0.8g
36.5:40=10gx:0.8g
x=7.3%
答:稀盐酸中溶质的质量分数为7.3%。
