[化学——选修2:化学与技术](15分)
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
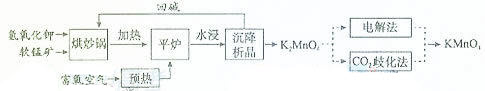
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是()。
(2)“平炉”中发生的化学方程式为()。
(3)“平炉”中需要加压,其目的是()。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和()(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为(),阴极逸出的气体是()。
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为()。
(5)高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为0.2000mol·L−1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为()(列出计算式即可,已知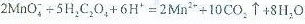 )。
)。
参考答案:
(1)扩大接触面积,加快化学反应速率。
(2)
(3)增大反应物的浓度,可使化学反应速率加快,同时使反应物的转化率增大。
(4) ① K2CO3;②MnO42--e-=MnO4-;③3:2。
(5)95.62%。
