问题
问答题
[化学——选修3:物质结构与性质](15分)
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar](),有()个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是()。
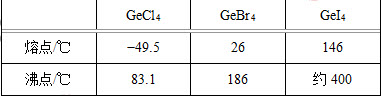
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因()。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是()。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为(),微粒之间存在的作用力是()。
(6)晶胞有两个基本要素:
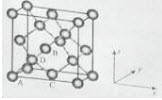
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为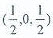 ;C为
;C为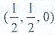 。则D原子的坐标参数为()。
。则D原子的坐标参数为()。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为()g·cm-3(列出计算式即可)。
答案
参考答案:
(1)3d104s24p2;2;
(2)锗元素原子半径大,难以通过“肩并肩”方式形成π键;
(3)GeCl4、GeBr4、GeI4均为分子晶体。组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高。相对分子质量GeCl4<GeBr4<GeI4,所以,熔沸点GeCl4<GeBr4<GeI4;
(4)O>Ge>Zn;
(5)sp3;共价键(或非极性键);
(6)①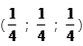 ;②
;②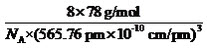 。
。
