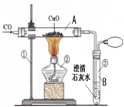
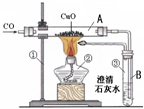
关于一氧化碳还原氧化铜的实验,三个组的同学设计了如下甲、乙、丙三套实验装置,请根据下列要求回答有关问题:
|
|
|
| 甲 | 乙 | 丙 |
②实验过程中,A管内发生化学反应的现象是______,化学方程式是______,B管内的发生反应的现象是______反应的化学方程式是______.
③装置丙与装置乙相比,它的主要优点是______;
④如果对甲装置进行改进,可用于实验室证明碳与氧化铜的反应,此反应的化学方程式为______,发生还原反应的物质是______,需要对甲装置做哪些改进______.
①一氧化碳具有可燃性,加热一氧化碳与空气混合气体可能发生爆炸,实验开始时,要先通一会儿一氧化碳然后再加热,目有的是排尽玻璃管中的空气,防止一氧化碳与空气混合后发生爆炸.实验结束时要先熄灭酒精灯停止加热,继续通一氧化碳到试管冷却.防止生成的铜又被氧化成氧化铜;
②一氧化碳还原氧化铜生成铜和二氧化碳,故看到的现象为:黑色粉末逐渐变红;化学方程式为 CO+CuO
CO2+Cu. △ .
二氧化碳与氢氧化钙反应生成难溶于水的碳酸钙,故澄清石灰水变浑浊,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
③丙装置将剩余的一氧化碳作为燃料给氧化铜加热,这样变废为宝;充分利用能源;更能有效利用能源.
④碳还原氧化铜的条件是高温,所以此装置的改进应该是在酒精灯火焰上加金属网罩或改用酒精喷灯,且完全反应时不会有一氧化碳生成,所以可去掉气球,其方程式为:C+2CuO
CO2+2Cu,该反应中氧化铜被还原生成了铜,发生了还原反应; 高温 .
故答案为①通入一氧化碳;点燃酒精灯;热的铜被氧化;
②黑色粉末逐渐变红; CO+CuO
CO2+Cu;澄清石灰水变浑浊; Ca(OH)2+CO2=CaCO3↓+H2O; △ .
③变废为宝;更能有效利用能源(合理即给分).
④C+2CuO
CO2+2Cu;氧化铜;改用酒精喷灯加热,去掉气球; 高温 .