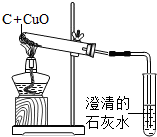
学了课本中C和CuO的反应后,小明同学为了探究木炭还原氧化铜所生成的气体产物是什么,提出了猜想:a.可能是二氧化碳;b.可能是一氧化碳.并设计如如图所示装置进行实验,预期的实验现象及结论如下:
①若澄清的石灰水变浑浊,则气体为二氧化碳;
②若澄清的石灰水不变浑浊,则气体为一氧化碳.
请你回答:
(1)该同学的猜想是否严谨?若不严谨,请作补充.______
(2)请你对该实验装置予以评价.______
小亮同学对反应后产生的红色固体的成分提出了疑问,并进一步进行探究.
【查阅资料】①C也能将CuO还原为红色固体Cu2O(氧化亚铜) ②Cu2O+H2SO4(稀)=Cu+CuSO4+H2O ③+2价铜盐的水溶液呈蓝色.
【猜 想】(a)红色固体只是Cu (b)______ (c)红色固体是Cu和Cu2O的混合物
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 取7.2g红色固体于烧杯中加入足量稀硫酸,充分搅拌,静置. | 若无现象 | 证明红色故题为:______ |
| 若:___________________ | 证明红色固体肯定含_____ 可能含有___________ | |
| 取上述反应液过滤、洗涤、干燥、和称重,得固体6.8g | 确认红色固体是_________ |
(1)考虑产物的气体情况时没有考虑是混合气体的情况,故答案为:不严谨,有可能是一氧化碳与二氧化碳的混合气体
(2)从一氧化碳会污染空气,以及(1)的分析写出对实验的评价,故答案为:①产生一氧化碳会污染空气②产物是一氧化碳与二氧化碳混合气体时无法验证.
【猜想】从a、c可以看出红色固体可能是铜,氧化亚铜,和两者的混合物,故答案为:红色固体只有Cu2O
设:生成6.8g铜需氧化亚铜的质量是x
Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
144 64
x 6.8g
=144 x 64 6.8g
x=15.3g,由于15.3g>7.2g
因此可判断原固体不可能是只有氧化亚铜,故是铜与氧化亚铜的混合物故
答案为:
| 实验操作 | 实验现象 | 实验结论 |
| 取7.2g红色固体于烧杯中加入足量稀硫酸,充分搅拌,静置. | 若无现象 | 证明红色固体为:铜 |
| 若:溶液变蓝 | 证明红色固体肯定含:氧化亚铜 可能含有铜 | |
| 取上述反应液过滤、洗涤、干燥、和称重,得固体6.8g | 确认红色固体是:铜和氧化亚铜 |
