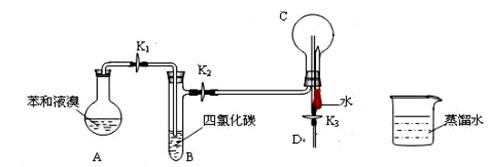
Ⅰ、德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:①按下图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。
试回答:
(1)写出A中发生反应的化学方程式 ;能证明凯库勒观点错误的实验现象是 ;
(2)装置B的作用是 ;
Ⅱ、用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
Ⅰ、(1)方程式 +Br2
+Br2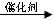
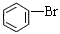 +HBr 烧瓶中形成喷泉现象
+HBr 烧瓶中形成喷泉现象
(2) 吸收苯、溴蒸气
Ⅱ、(2)碱式滴定管(也可使用移液管来量取)(3)两眼注视锥形瓶中溶液颜色的变化。
(4)0.4000mol/L(5)80%
题目分析:Ⅰ、(1)苯与溴在铁(或溴化铁)做催化剂的条件下发生取代反应,生成溴苯和溴化氢;反应的化学方程式为: +Br2
+Br2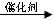
 +HBr,苯分子里的氢原子被溴原子所代替,发生的是取代反应,不是加成反应,说明苯分子中不存在碳碳单双键交替,所以凯库勒的观点错误,生成的溴化氢极易溶于水,所以烧瓶C中形成喷泉;
+HBr,苯分子里的氢原子被溴原子所代替,发生的是取代反应,不是加成反应,说明苯分子中不存在碳碳单双键交替,所以凯库勒的观点错误,生成的溴化氢极易溶于水,所以烧瓶C中形成喷泉;
(2)由于反应放热,苯和液溴均易挥发,易溶于四氯化碳,用四氯化碳除去溴化氢气体中的溴蒸气和苯,以防干扰后面的实验,装置B的作用是吸收苯、溴蒸气。
Ⅱ、(2)待测液是烧碱样品溶液,显碱性应用碱式滴定管量取;
(3)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断滴定终点;
(4)第3组数据误差较大计算时应舍弃,取前两组数据进行计算,
V(标准)═[(20.40-0.50)+(24.10-4.00)]mL÷2═20.00mL根据C(待)V(待)═C(标)V(标)计算得C(NaOH)=0.4000mol•L-1,
(5)样品中NaOH的物质的量n(NaOH)═C(NaOH)V(NaOH)═0.4000mol•L-1×0.25L═0.1000mol,m(NaOH)= n(NaOH)M(NaOH)=4.000g,质量分数为80%。
