某金属M的氢氧化物的水合晶体[M(OH)2•xH2O]与Na2CO3混合物共36.800g,加入足量的水后,生成MCO3的白色沉淀,将沉淀滤出,洗净烘干,其质量为9.850g。
47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体_______mol。
48.滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH‑的物质的量为_______mol。
49.M的相对原子质量为_________;试通过计算确定M(OH)2•xH2O中x的值:
47. 0.05(2分)。
48. 0.2mol(2分)。
49. 137(3分);8(3分)。
题目分析:47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体9.850g-7.650g=2.200g,即0.05mol。
48.M(OH)2+Na2CO3→MCO3↓+2NaOH,滤液与酸作用不产生气体,说明不含碳酸盐;足量的铵盐与滤液共热,NH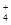 +OH-→NH3↑+H2O,产生标准状况4.48L气体,即0.2mol,滤液中OH‑的物质的量为0.2mol。
+OH-→NH3↑+H2O,产生标准状况4.48L气体,即0.2mol,滤液中OH‑的物质的量为0.2mol。
49.由MCO3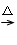 MO,0.05mol MCO3是9.850g,故(Mr+60)×0.05=9.850,Mr=137。
MO,0.05mol MCO3是9.850g,故(Mr+60)×0.05=9.850,Mr=137。
由此可知36.800g混合物中含有0.2mol M(OH)2•xH2O、0.05mol Na2CO3:
0.2×(197+18x)+0.05×106=36.800,x=8。
